氯代有机物脱氯时pH值变化影响因素的研究
吴德礼,马鲁铭,王铮,徐文英
(同济大学环境科学与工程学院城市污染控制国家工程研究中心,上海 200092)
摘要:研究了氯代有机物在Fe/Cu双金属体系中发生还原脱氯反应时pH值的变化与影响因素,结果表明在脱氯过程中pH值会不断发生变化,pH值条件对还原脱氯有很重要的影响,其最佳初始pH值条件为4-5左右,但是该反应体系有较强的pH值缓冲功能,能够适应较广的pH值变化范围。
关键词:氯代有机物;催化还原;还原脱氯;pH值变化
中图分类号:X703.1 文献标识码:A 文章编号:1009—2455(2004)05—0043—04
A Study of Factors Affecting VariaUon of pH Values during Dechlorination of Chloroorganics
wu De-li,MA Lu-ming,WANG Zheng,XU Wen-ying
(The State Engineering Research Center for Municipal Pollution Control under the College of Environmental Science and Engineering, Tongji University,Shanghai 200092,China)
Abstract: A study was made on the variation of pH values in the reductive dechlorination of chloroorganics in a Fe/Cu bimetal system as well as the affecting factors.The results show that the pH values keep changing during dechlorination,the conditions of pH vahles have a very important influence on reductive dechlorination,the optimum initial pH value is around 4—5,while the said reaction system has a strong pH value buffering function and is adaptable to a wide range of variation of pH values.
Key words:chloroorganics;catalytic reduction;reductive dechlorination;variation of pH values
氯代有机物的污染一直是非常重要的环境问题,得到各国的广泛关注。利用零价金属(如铁、铝、锌等)还原脱氯处理氯代有机物是最近几年发展起来的新技术[1-2],由于单质铁价廉易得,而且不会产生二次污染,所以得到了广泛的应用,被认为是应用前景广阔的污染物治理技术[3-5]。
目前的研究主要集中在利用金属铁粉来修复受氯代有机物比如PCE,TCE等[6-7]污染的地下水方面。为改善脱氯效率,也有研究通过加入钯、镍等贵金属做为催化剂来加速氯代有机物的还原脱氯速率和提高脱氯程度[8-9]。关于反应的机理和动力学问题目前还存在着很多争论,其中pH值的变化和影响在目前的研究中就还没有定论[10],由于在氯代有机物的还原脱氯过程中有H+的参与,所以pH值会在反应过程中起到非常重要的作用,而且随着反应的进行溶液的pH值可能会发生变化,所以本文重点讨论氯代有机物在Fe/Cu双金属体系中发生还原脱氯时pH值的变化以及影响因素的研究。这对于推动金属还原技术的实际应用是非常重要的。
1 实验方法
在实验中使用的是铁刨花和铜刨花组成的混合双金属系统,铜的加入能促进铁的腐蚀氧化,加速铁与氯代有机物反应的进行。将从机械加工厂取来的铁刨花和铜刨花进行除油清洗处理以后,用高纯水清洗,用硝酸汞滴定法检测氯离子直至清洗液中无氯离子为止,然后将其烘干。称取一定量的烘干后的铁刨花和铜刨花(两者按一定的比例称取),将其混合均匀后装入实验瓶中并将其压实,堆积密度约为0.5 kg/L。
受试溶液分别用四氯化碳和1,1,2,2—四氯乙烷与蒸馏水配制而成,pH值使用硫酸或氢氧化钠调节。溶液配置好以后将其加入实验瓶中,然后用包有聚四氟乙烯膜的橡皮塞将瓶口塞紧,放人摇瓶柜中以恒定速度摇动,温度控制在25℃。定期取样分析溶液中的氯离子浓度和pH值的变化以及通过GC/MS检测反应产物。
2 实验结果
在pH值中性初始条件下,实验了四氯化碳(CCl4)和1,1,2,2—四氯乙烷(C2H2C14)溶液的还原脱氯研究,配制的CCl4溶液和C2H2C14溶液的质量浓度分别为217mg/L和222mg/L。其还原脱氯反应过程中脱氯量与反应时间的关系如图1所示。从图1中可以看出,溶液中Cl-浓度增加得很快,经使用Finnigan Voyager气相色谱—质谱联用仪(GC/MS)检测,其中CCl4的主要脱氯中间产物为CHCl,和CH2Cl2,而1,1,2,2—四氯乙烷的主要脱氯中间产物为1,2—二氯乙烯。所以通过金属单质铁的还原作用和铜的催化作用,可以有效的使氯代烃发生还原脱氯反应。
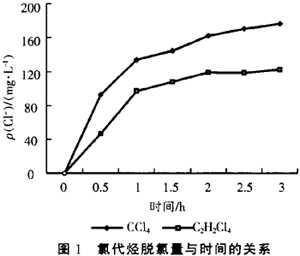
3 pH值对脱氯反应的影响
铁、铜双金属体系对氯代有机物的还原脱氯反应受pH值变化的影响如图2所示,图2中实验以CCl4溶液的还原脱氯反应为例,CCl4的初始质量浓度均为200ms/L,反应时间为1 h,溶液初始pH值分别用硫酸和氢氧化钠调节。
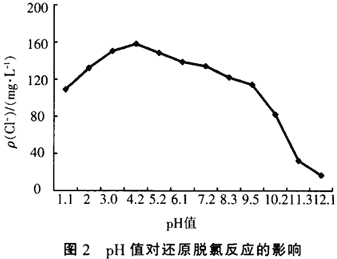
从图2中可以看出,pH值对还原脱氯反应影响很大,pH值过高或过低都会减慢脱氯反应,尤其是在pH值大于10以后,脱氯速率直线下降,效果非常差。其原因是在该体系中还原脱氯主要是发生如下反应:
Fe0+RClx+H++Fe2++RHC]x-1+Cl-
在该反应中要消耗H’,而在强碱性环境中H+浓度非常低,并且由于反应:Fe0+2H2O→Fe(OH)2+2H+而生成的H+也会立即与OH-结合成水,同时由于水中存在溶解氧,在碱性环境中容易发生反应:O2+2H2O+4e+4OH-,所以铁释放的电子很容易被0:得到,所以在高pH值条件下,还原脱氯反应很难进行。在强酸性环境中,由于存在过多的H+,结果会优先发生析氢反应,即H+与氯代有机物争夺Fe0氧化所释放的电子,而发生如下反应:2H++2e→H2,所以也会影响氯代有机物的还原脱氯反应。从实验中看出溶液pH值在4-5之间是最有利于发生还原脱氯反应的,但是也可以看出该体系适应pH值范围很广,pH值在2—9之间都有不错的还原脱氯效果,在此范围内pH值影响不是特别大。
4 反应过程中pH值的变化
4.1 中性初始条件下oH值的变化
实验中发现,在氯代有机物的还原脱氯处理过程中,溶液的pH值是不断变化的。在初始pH值为中性条件时,含氯有机物的溶液经处理后,pH值都有不同程度的降低,一般最后能降到5左右,而且处理效果越好,pH值降得越低。图3是在处理CCl4溶液过程中pH值随脱氯过程的变化,溶液初始pH值为7.2。
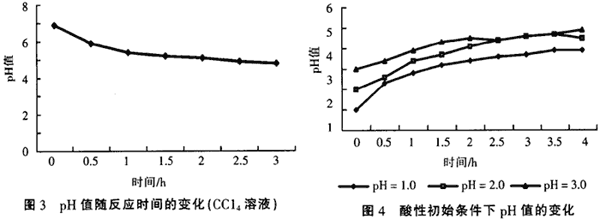
氯代有机物在铁、铜体系中发生的还原脱氯反应可用下面的方程来表示(初始为中性条件下),
Fe0+2H2O+Fe(OH)2+2H++2e
RClx+H++2e→RHClx-1+Cl-
总的方程式为
Fe+2H2O+RClx→Fe(OH)2↓+RHClx-1+HCl
所以当1 mol的RClx发生还原脱氯以后,就会产生1 mol的HCl,pH值自然会降低,这是在假定Fe2+完全沉淀的情况下,但在当时的pH值条件下,Fe2+沉淀不完全,而且随着pH值的降低,又会有部分Fe(OH)2沉淀溶解,消耗部分H+,对pH值起到缓冲作用,所以H+的产生量并非与RClx的还原量呈严格正比关系,同时pH值也不会降到很低,一般在5.0左右,如果pH值降到很低,就不会产生Fe(OH)2沉淀,如果反应不产生Fe(OH)2沉淀则会发生如下反应:
Fe+H++RClx→Fe2++RHClx-1+Cl-
所以在反应过程中会消耗H+,导致pH值回升,而且在以前产生的Fe(OH)2沉淀这时也会与H+反应而溶解,因此pH值就不会继续降低,该体系对pH值有缓冲调节作用。
4.2 酸性初始条件下pH值的变化
中性初始条件下,随着反应的进行溶液pH值不断下降,而在酸性初始条件下,随着反应的进行pH值却在不断上升,但是在最后只是上升到pH值为5.0左右。该实验仍以四氯化碳溶液的还原脱氯处理为例,配制了3种不同pH值条件的四氯化碳溶液,但初始都是在酸性条件下,CCl4溶液的初始质量浓度为200mg/L,pH值分别为1.0,2.0和3,0,3种溶液还原脱氯处理过程中pH值的变化如图4所示。
从图4可以看出,在酸性初始条件,随着还原脱氯反应的进行,溶液pH值开始升高,而且一开始升高的较快,到2h后变得非常缓慢,最后基本都稳定在4.5左右。因为在酸性条件下主要是发生了如下反应:Fe+2H+→Fe2++H2
Fe+RCl+H+→Fe2++RH+Cl-
所以会大量消耗溶液中的H+,致使溶液pH值开始升高,在反应刚开始时,H+充足,所以会迅速发生析氢反应,pH值变化很快,随着反应的进行,H+浓度越来越少,析氢反应也就越来越弱,主要发生还原脱氯反应了,所以pH值变化较为缓慢。因此铁铜反应体系具有良好的pH值调节缓冲功能,如果时间允许,该体系可以自动调节pH值,等消耗一定量的铁后,pH值就会调节到一定范围,使一开始较为缓慢的还原脱氯反应开始加速,所以该方法能耐pH值变化冲击,在较宽的pH值变化范围内都有很好的还原脱氯效果。
4.3 碱性初始条件下pH值的变化
该反应体系不但能调节缓冲酸性pH值条件,也能够承受一定的碱性pH值变化。在初始条件为碱性时,随着反应的进行pH值也会逐渐降低,但是此条件下调节能力不强,经过一段时间后,pH值仍在7以上。仍以四氯化碳溶液为例,配制了3种不同pH值条件的四氯化碳溶液,CCl4溶液的初始的质量浓度为200mg/L,pH值分别为8,10和12,3种溶液还原脱氯处理过程中pH值的变化情况如图5所示。
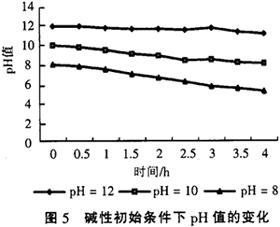
从图5可以看出,铁、铜双金属体系在还原脱氯处理氯代有机物时对强碱性,高pH值溶液的缓冲适应能力不是很强,尤其是在pH值大于10以上,从图5看出,初始pH值为12的CCl4溶液在反应过程中pH值基本没有什么变化,而实验证明该条件下还原脱氯效果也是非常差的,而对于初始pH值为8的CCl4溶液,在整个反应过程中pH值下降了很多,最后经过4个小时后pH值能达到5.5左右,而脱氯实验也证明在初始pH值为8时仍有很好的还原脱氯效果。
在强碱性溶液中(pH值大于10以上),蚀氧化的很慢,而且主要是发生了吸氧腐蚀:2Fe0+2H2O+O2→2Fe(OH)2↓
由于H+浓度非常低,而OH—浓度非常高以下面反应是非常有限的:Fe0+2H2O→Fe(OH)2+2H++2e
Fe+RClx+H+→Fe2++RHClx-1+Cl-
所以在此条件下还原脱氯反应难以发生,脱氯效果不好,而且溶液pH值的缓冲调节功能不强。而对pH值为8的初始条件,由于溶液中碱性不是特别强,所以仍有很大的可能发生还原脱氯反应,而且在此条件下铁氧化产生的Fe2+几乎都转变为了Fe(OH)2沉淀,所以随着反应的进行,在脱氯过程中就会产生很多H’,这样很快就中和了溶液中过多的OH-,使溶液pH值不断下降,pH值下降也进一步促进了还原脱氯反应的进行,所以最终pH值还可以降到6以下,而且仍旧有很好的还原脱氯效果。所以该反应体系对碱性环境也有很好的缓冲调节功能,但是如果在强碱性(pH>10)的初始条件下,体系将失去部分pH值调节功能,不能达到非常理想的还原脱氯效果。
5 结语
在氯代有机物的还原脱氯反应过程中,pH值有着重要的影响,在该实验中最佳的初始pH值条件为4-5左右,但是由于该反应体系有着很好的pH值缓冲调节功能,在反应过程中pH值会有不同的变化,所以该体系可以适应较广的初始pH值条件,在初始pH值从2.0到9.0的范围内都有很好的还原脱氯效果。但是该反应体系不能适应强碱性环境,所以在实际应用中要考虑废水pH值的的影响和变化,如果pH值大于10以上,要考虑调节溶液的pH值。
参考文献:
[1] J Morales,R Hutcheson.Dechloriantion of chlorinated phenols by catalyzed and uncatalyzed Fe(0)and Mg(0)Prticles[J].Joumal of Hazardous Materials,2002,B90:97—108.
[2] Tatiana N B,LagadicI,Gleb B Sergeev,et al.Activated and nonactivated forms of zinc powder: reactivity toward chloroearbon in water and AFM Studies of surface morphologies[J].Environ Sci Technol,1998,32(17):2614—2622.
[3] Andrews E J, Novak P J.Influence of ferrous and pH oncarbon tetrachlohde degradation by methanosarcina thermophila[J].water research,2001,35(9):2307—2313.
[4] Deng B,Burris D R,Campbell T.Reduction of vinyl chlorinated in metallic iron-water system[J].Environ Sci&Technol,1999,33(15):2651—2655.
[5] Hozalski R M,Zhang L,Arnold W A.Reduction of haloacetic acids by FeO:implications for treatment and Fate[J].Environ Sci Technol,2001,35(11):2258—2263.
[6] Ruiz N,Seal S,Reinhart D.Surface chemical reactivity in selected zero—valent iron samples used in groundwater remediation [J].ournal of Hazardous Materials,2000,B80:107—117.
[7] slater G F.Isotopic fractionation during reductive dechlorination of trichloroethene by zero—valent iron:influence of surface treatment[J]. chemosphere,2002,49(4):589—596.
[8] Tsyganok A I,Otsuka K.Selective dechlorination of chlorianted
phenoxy herbicides in aqueous medium by electrocatalytic reduetion over palladium—loaded carbon felt[J].Applied Catalysis B:Environmental,1999,22(1):12—26.
[9] Clark Ⅱ C J,Rao P S C,Annable M D.Degradation of perchloroethylene in cosolvent solutions by zero-valent iron [J].Journal of Hazardous materials,2003,B96:65—78.
[10] Chen J L,AI—Abed S R,Ryan J A,et al.Effects of pH on dechlohnation of trichloroethylene by zero—valent iron [J].Journal of Hazardous Materials,2001,B83:243—254.
作者简介:吴德礼(1977—),男,山东潍坊人,博士生,电话(021)65986832,65982106,wdli101@163.com。
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








