制革工业污泥中Cr3+的回收试验
胡明成
桂林电子工业学院,广西 桂林 541004
提要 对制革工业污泥中Cr回收与再利用进行了试验。试验表明:Cr的总回收率的高低主要决定于 Cr3+的氧化是否彻底,在n(H2O2):n(Cr3+)为7.5,pH=10,温度为60℃以及反应时间为30min的条件下,污泥中 Cr3+氧化率接近90%,总回收率可以达到 80%以上。
关键词 制革污泥;污泥处理;金属铬;铬回收
中图分类号:X703;X794 文献标识码:A 文章编号:1009-2455(2003)02-0040-03
A Test of Recovery of Cr3+ in Sludge from Tanneries
HU Ming-cheng
(Electronic Engineering Institute Of CuiLin,Guilin 451004,China)
Abstract:The recovery and reuse of Cr3+ in the sludge from tanneries were tested.The results showed:the total recovery rate of Cr3+ depended largely on whether the oxldation of Cr3+ was suffcient or not.When n(H2O2):n(Cr3+)was 7.5,pH=10,temperature was 60℃ and reaction time was 30 min,the oxidation rate of the Cr3+ in the sludge was close to 90% and the total recovery rate was over 80%.
Key WOrdS:sludge from tannery;sludge treatment;metal chromium;chromium recovery
目前,铬躁法广泛应用于皮革工业。因此,Cr3+是这类工业所排放的废水和污泥中的主要污染物质。在制革工业污泥中Cr3+ 的质量比可以达到 1500 mg/kg[干污泥][1-3]。表1为某制革厂污泥干化场污泥的采样分析结果。目前,对于这类污泥主要是采用填埋的处理方法,但由于污泥产量大,填埋处理需占用大量的土地资源。同时还存在潜在的污染。所以,对这类污泥中Cr元素的回收与再利用显得十分紧迫。
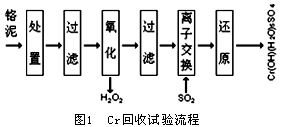
1 试验流程
图1所示为Cr回收的试验流程。首先,在室温条件下,将污泥搅拌均匀,用硫酸调节pH值到1,停留12h,使污泥中的Cr3+充分溶解。经过滤后得到提取液,提取液中主要阳离子的质量浓度见表2。将提取液的PH值调节到10,用双氧水将提取液中的Cr3+氧化,之后将提取液的pH值调节到7-8之间,使混合液中Fe3+ 和Al3+沉淀下来,过滤后将其去除。此后经过Na型阳离子交换树脂将Ca2+和Mg2+去除,将最后得到的Cr2O72-经过SO2还原后就可以获得制革工业所需要的化学原料Cr(OH)(H2O)5SO4。
在初步试验和对比试验中使用的配制水样中Cr3+的质量浓度均为 1000 mg/L,采用三价铬盐加蒸馏水配制而成。在对比试验中,又分别加入Fe3+,AL3+,Ca2+,Mg2+,将所得到的结果与不加任何其它阳离子的配制水样中Cr3+氧化结果相比较以评价提取液中所存在的Fe3+,Al3+,Ca2+,Mg2+,对Cr3+氧化过程的影响。
元素 采样1 采样2
ω(Cr3+) 4.6 4.2 ω(Fe3+) 2.4 1.2 ω(Al3+) 0.2 0.15 ω(Mg3+) 0.5 0.3 ω(Ca3+) 4 3.3
注:污泥含水率在60%-70%之间。
表2 提取液中主要阳离子的质量浓度 mg·L-1
ρ(Cr3+) ρ(Fe2+) ρ(Al3+) ρ(Ca3+) ρ(Mg2+)
1160 250 600 530 116
2 Cr3+ 氧化
为了确定 Cr3+氧化过程的基本参数,我们首先以配制水样为试验对象对温度(θ),pH值,反应时间(t)以及投加的n(H2O2)与n( Cr3+)之比(R)对Cr3+氧化率的影响做了初步试验。试验表明:在θ=60℃,t=30 min,pH=10,R=1.5的反应条件下,取得的氧化率为83.4%。有关试验结果分别参见图2和图3。从这些结果中我们可以看到θ,R,pH值对 Cr3+的氧化过程影响较大。 Cr3+氧化的化学方程式如下:
2Cr(OH)2++3H2O2+8OH- → 2CrO42- +8H2O
因为在pH=10的条件下, Cr3+以Cr(OH)2+络合物的形式存在[-2],另外,反应器中 Cr3+的质量浓度远远大于其在该状态下的饱和溶解度,所以会有Cr3+的深沉物质生成,使得氧化率就需要延长反应时间和提高反应温度。
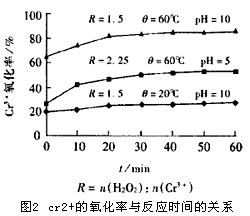
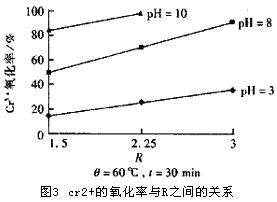
在初步试验所取得的数据基础上,我们以θ=60℃ ,t=30 min,pH=10,R=1.5为反应的基本条件对提取液中的Cr3+进行了氧化试验。在该反应条件下仅获得了60%的氧化率。但是,进一步试验表明:提高n(H2O2)与n(Cr3+)的比值R,可以取得较高的氧化率。相关试验结果见表3。
序号 R=7.5(提取液) R=1.5(配制水样)
1 89.3 82.4 2 88.3 83.0 3 88.8 84.4 4 89.3 84.0 平均 89.0 83.4
注:θ=60℃ ,t=30 min,pH=10
为了解释在取得相同氧化率的前提下,在对提取液的氧化过程中需要较高氧化剂H2O2投加比 R的原因,我们对提取液中Fe3+,Al3+,Ca2+,Mg2+对氧化进程的影响做了对比试验。结果发现:Fe2+和Mg2+的存在是导致在氧化过程中H2O2 投加比过高的主要因素。由于在调节提取液的PH过程中,Fe2+和Mg2+能够和Cr2+形成比较难溶解的某种络合物,使整个氧化进程减缓,导致氧化剂的投加比较高[4]。有关对比试验的结果见图4。
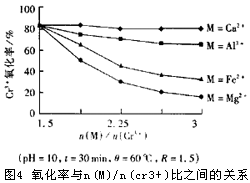
在不同的 n(Fe2++Mg2+)/n(Cr3+)值(N)以及采用不同R值的情况下,Cr3+氧化率的试验结果见表4。表4中的试验数据对氧化过程具有很重要的意义。我们可以根据所要取得的氧化率以及提取液中的N值确定H2O2的最佳投加比R。
N R Cr6+产率/%
0.25 7.5 90 0.3 7.5 88 0.5 6 85 0.6 10.5 83
注:θ=60℃,t=30 min,pH=10,N=n(Fe2++Mg2+)/n(Cr3+)。
3 其它离子的去除
经过氧化后提取液中还存有其它金属离子,这些离子包括:Fe3+,Al3+,Ca2+,Mg2+以及其它微量的金属离子。所以,要回收Cr还需要将这些离子去除。实验室试验和相关研究报道都表明:其它离子的去除比较容易,而且这个阶段的效率高,所以这个阶段不是影响总回收效率的关键阶段[5]。
为了去除Fe3+,Al3+应首先将混合液的PH调节到7-8之间,使Fe3+和Al3+以沉淀的形式存在,通过过滤的方法(20-50目滤料)将其去除。值得注意的是要想完全去除Al3+,过滤之前需将混合液在pH=7-8,温度为60℃的状态下,停留30 min。经过过滤处理后,滤液中还存有的Ca2+,Mg2+以及其它微量的金属离子。这些金属离子可以通过Na型阳离子交换树脂将其去除。经过离子交换后Ca2+,Mg2+离子可以降低到检测不到的水平。
4 Cr的回收
经过以上处理后,就可以得到较纯的Cr6+,在酸性以及接近中性的情况下Cr以Cr2O72-的形式存在。由于制革工业中所需要的是三价铬的碱式硫酸盐,因此需要将所得到的Cr2O72-进一步还原。以SO2为氧化剂可以将其还原为三价铬的碱式硫酸盐[1-2],化学反应方程式如下:
Cr2O72-+3SO2+11H2O → 2Cr(OH)(H2O)5SO4+SO42-
在室温且稍过量投加SO2的条件下,上述反应可在短时间内完成。
5 结论
实验室研究结果表明:
①通过该流程,污泥中Cr的总回收率可以达到80%以上。
②Cr的总回收率与Cr3+氧化是否彻底有很大关系,而 Cr3+氧化主要受提取液中n(Fe2++Mg2+)与n(Cr3+)之比的影响,当提取液中n(Fe2++Mg2+)与 n(Cr3+)比小于 0.25,Cr的总回收率可以接近 90%。
参考文献:
[1] Anderson R A.Essentiality of Chromium in humans[J]. Sci Total Emvir,1989,23(1):75-81.
[2] Beecari M, Campanellla L Caldarelli E. Chromlum recovery fromtennery Sludge by incineration and acid extraction [C] .The Second International Symposium of metals Speclation,Separation and Re-covery.1990,24(5):587-602.
[3] G Macchi.A Study on Chromium Recovery [J]. water Reseach,1991.25(3):1019-1026
[4] Aoki T,Munlmori M. Recovery of Chromium(Ⅵ)from wastewaters with irom(Ⅲ)hydroxide-I [J]. Water Researh,1982,16(4):793-796.
[5] 石国乐,张凤英. 给排水物理化学[M] 北京:中国建筑工业出版社,1998.158-164.
作者简介:胡明成(1968-),男,山东阳谷县人,1998年毕业于哈尔滨工业大学市政与环境工程学院,硕士,现任桂林电子工业学院环境工程教研室主任
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








