紫外线去除水中微量苯研究
李俊杰1,王郁1,林逢凯1,胥峥1,袁园2
(1.华东理工大学资源与环境工程学院,上海200237;
2.同济大学污染控制与资源?化研究国家重点实验室,上海200092)
摘 要:紫外线(UV)能去除水中微量苯(<10 mg/L),其反应过程可用一级动力学方程描述,但其降解速度较快,这是该技术降解水中微量苯的一个特点。当pH值为7时,其去除速率常数k为0.335h-1,半衰期为2.07 h;在pH值为5~9的范围内,速率常数和半衰期变化不大。此外,测定了苯降解过程中溶解氧(DO)和苯酚浓度的变化,讨论了苯降解的机理。
关键词:微量苯;紫外线;溶解氧;苯酚;pH值?
中图分类号:X505
文献标识码:A
文章编号:1000-4602(2001)10-0012-04
Study on the Use of UV for Removal of Trace Benzene from Water
LI Jun?jie1,WANG Yu1,LIN Feng?kai1,XU Zheng1,Yuan Yuan2
(1.College of Resources [WT]&[WTBX] Environmental Engineering,East China Univers ity of Science and Technology,Shanghai 200237,China;
2.State Key Lab of Pollution Control and Resource Reuse,Tongji University,Shanghai 200092,China)
Abstract:The reaction process in which trace benzene (<10 mg/L) can be removed from water by UV is in conformity with the first order kinetic equation and characterized by its relative rapid velocity of trace benzene degradation in water.It was obs erved that at pH value of 7,the rate constant is 0.335 h-1 and the half?l ife of removing benzene is 2.07 h,and there is little change both in rate consta nt and half?life as pH value is in the range of 5~9.Furthermore,the variation of DO and phenol concentration was measured in the process of benzene degra dation, and the mechanism of benzene degradation was discussed.?
Keywords:trace benzene;UV;DO;phenol;pH value
由于苯在水中有一定的溶解性(1.80g/L)[1],常见的物化方法不能将苯彻底从水中去除。例如孙勤和李仲英[2]利用絮凝→气浮→吸附过滤工艺去除水中的苯,只 能去除到2.4 mg/L。因苯非常稳定,常温常压下很难起化学反应,用普通的化学方法亦难以去除,但苯对230~270 nm的UV有强吸收能力,该波段的能量约为448 kJ/mol,远远超过了苯的共轭能(151kJ/mol)[3]。[HJ]在UV作用下,苯可以异构化或与其他物质发生反应 。由此看来,用UV作为净水技术不仅能消毒,还能去除水中微量苯。以高压汞灯为UV光源,对影响苯降解的因素如pH值和溶解氧做了研究,探讨了UV去除水中微量苯的机理。
1 试验内容及方法
①主要仪器与试剂?
GGZ型500 W高压汞灯;石英反应器(自制);JPB607型便携式溶解氧分析仪;数字式pH/mV计;752紫外光栅分光光度计;HP—4890A型气相色谱仪;苯(G.C)。?
②苯—水溶液的配制?
用经空气饱和的去离子水(DO=8.0 mg/L)配制含微量苯水溶液,用氢氧化钠和盐酸调节pH值。?
③光解试验?
在石英反应器中加入100 mL在不同条件下配制的8.78 mg/L苯溶液,在距高压汞灯40 cm处实施光照。石英反应器上的小口(内径为2 mm)与大气相通,以保证光照反应中氧的自然补充。
④溶液中残留苯的定量测定?
用10 mL二氯甲烷萃取100 mL在不同条件下光解的苯溶液,萃取时加入5g氯化钠。用硫酸钠干燥二氯甲烷萃取液1d后,再进行恒温色谱分析,根据色谱峰面积计算出苯的浓度。色谱条件:HP—5色谱柱为30 m×0.53 mm×0.88 μm的毛细管柱,载气(N2)流量为0.547mL/min,柱温为65 ℃,检测器和汽化室温度均为250 ℃。
⑤光解过程中DO的测定?
采用便携式DO分析仪,每隔一定光照时间测定苯溶液(苯的原始浓度为8.78 mg/L)中的DO。?
⑥苯酚的定量分析?
用4-氨基安替比林直接光度法测定苯酚的含量[4]。?
2 结果与讨论
2.1 光照时间和值对苯光解的影响
表1为不同pH值条件下,溶液中苯的浓度与光照时间的关系。
由于大多数原水的pH值在6.6~8.5的范围内,因此选择pH值为5.0、7.0、9.0的含苯水溶液进行试验。由表1可以看出,随着光照时间的增加,苯的浓度逐渐降低。
以表1中苯浓度的对数和光照时间做图,基本上呈一条直线,说明苯的光解符合一级反应,据此求出反应速率常数k和半衰期t1/2。不同pH值条件下的k和t1/2见表2。在此pH值范围内,pH值对苯的去除影响较小。这是因为光反应主要为自由基历程,自由基反应受pH值影响较小。
初始浓度为8.78 mg/L的苯降解速率常数(0.335h-1)比初始浓度为44 mg/L的降解速率常数(0.161h-1)大,这是低浓度苯降解时的一个特点,其原因在 于苯的降解过程中会产生同样对UV有吸收作用的产物,如苯酚。当初始浓度为44 mg/L的苯降解到8.78 mg/L时,产生的苯酚相对较多,吸收UV也就增加了。同初始浓度为8.78mg/L苯的降解相比,被吸收的UV就相对减少了,因此其降解速率常数小。?
2.2 光照过程中DO的变化
图1为苯光解过程中DO随时间的变化趋势。?
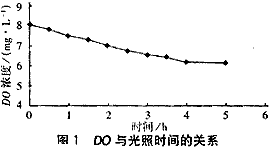
图1表明DO随着光照时间的增加而降低,这是因为苯及其光解中间体与DO反应的结果。DO消耗时,空气中的氧可以补充到溶液中;当消耗的和补充的DO相平衡时,DO保持不变(6.0 mg/L)。?
2.3 光照过程产生的苯酚
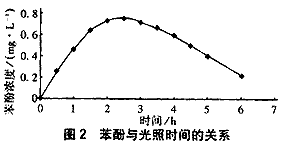
试验表明,随着光照时间的增加,产生的苯酚量逐渐增多。当光照时间为2.5 h左右时,达到最大值,随后逐渐减少。因为开始光照时,苯的浓度较高,产生的苯酚较多;随着光照时间的增加,一方面苯的浓度逐渐减小,另一方面苯酚在UV作用下也可以降解[5],苯酚的浓度就较小。因此当光照到一定时间,苯酚的浓度达到最大值后,苯酚的浓度逐渐减小。由此可见在UV作用下,苯酚亦会进一步降解,因而溶液中存在的苯酚较少。
图2为光照过程产生的苯酚与光照时间的关系。
2.4 苯降解机理分析
水中的苯在UV作用下要么与水中的DO反应,要么和水或氢氧根反应。Kapan等[6]认为在UV作用下,苯在水中发生的反应与DO关系不大。首先是苯异构为盆烯(Ⅰ),与水反应生成1,3-环戊二烯醛(Ⅱ)和环己二烯,反应过程表示如下:
![]()
用UV照射同位素标记的苯-d6水溶液,按上式得到的环己二烯的组成为C6H2D6,其中两个氢来自水,这进一步说明在无氧的条件下苯也可以降解。Loeff等[7]也认为苯在水中的反应同溶液中有无DO没有差别,但产物是己二烯醛。?
Luria[8、9]、Llan[10]等认为在UV照射下,苯主要与DO反应,产物是1,3-环戊二烯醛或者是2-甲酰基-4-氢-吡喃,反应式如下:?
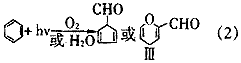
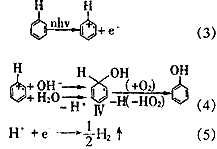
Irion等[11]用非聚焦的249 nm的激光照射苯的饱和水溶液时,得到的产物是环戊二烯醛,用聚焦的249 nm的激光照射时得到的是苯酚,产生苯酚的机理用如下方程式表示:
?
光反应多为自由基历程,反应的产物一般比较复杂。光学第一定律表明只有被分子吸收的光才能起光反应。苯的最大UV吸收为254 nm。吸收254 nm的光子后,苯变成了热分子,其能量相当于60000 ℃下苯的热能[12]。如此高能的苯可以和水或DO反应,生 成2-甲酰基-4-氢-吡喃、环戊二烯醛、己二烯醛、苯酚等含氧化合物,这些化合物也可以吸收UV与水或DO继续反应,进而被氧化分解,甚至矿化。笔者认为,高压汞灯照射下苯酚产生的历程以自由基历程为主,同Irion用激光照射苯溶液产生苯酚的机理不同。因为在高 压汞灯照射下,苯只能吸收一个光子,而在激光照射下苯可以同时吸收多个光子,发生异裂,产生苯正离子。由于降解产物不仅仅是苯酚,加上苯酚在UV作用下也降解,产生的苯酚较 少。?
3 结论
UV作用下苯可以和水或DO反应,生成2-甲酰基-4-氢-吡喃、环戊二烯醛、己二烯醛、苯酚等含氧化合物,这些化合物也可以吸收UV与水或DO继续反应,进而被氧化分解,甚至矿化。
水中微量苯的降解呈一级反应,pH为7时的降解速率常数为0.335h-1、半衰期为2.07 h。在pH为5~9范围内降解速率常数变化很小,说明pH对苯的降解影响不大。
在苯的降解过程中,DO有所降低,但空气中的氧能够补充其降低值。当DO降为6.0mg/L时则趋于恒定,无需向溶液中人为补充氧气。
苯酚仅是苯的降解产物之一, UV也能使苯酚进一步降解,溶液中残存的苯酚较少。
参考文献:
[1]H Stephen,?et al?.Solubilities of inorganic and organic compounds[M].Great B ritain,1(1):432.
[2]孙勤,李仲英.高浓度含苯废水的治理[J].环境科学与技术,1998(1):30-32.
[3]高振衡.有机光化学[M].北京:人民教育出版社,1979.
[4]国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法(第3版)[M].北京:中国环境科学出版社,1989.
[5]E.Llpczzynska-Kochany,?et al?.Flash photolysis/high-performance liquid chromat ography method for studying the sequenced of photochemical reactions:direct photolysis of phenol[J].Environ Sci Technol,1992,26:2524-2527.
[6]L Kaplan,?et al?.Photooxidation of aqueous benzene[J].Ⅰ.Identification of t he product as 1,3-cyclopentadiene-1-carboxaldehyde.Ⅱ.Role of benzvalene in the formation of cyclopentadienecarboxaldehyde.Journal of the American Chemical Society,1971,93(15):3819-3822.
?[7]Loeff,G Stein.The Radiation and photochemistry of aqueous solutions of benzene[J].J Chem Soc,1963,(2):2623-2633.
[8]Luria M,Stein G.The photochemistry of benzene in oxygenated aqueous solution in the ?1 B2u? first singlet state [J].The Journal of Physical Chemistry,1 972,76(2):165-171.
[9]Luria M,Stein G.The photoproduct of benzene in oxygenated aqueous solution [J].Chemical Communications,1970,1650-1651.
[10]Y Llan,?et al?.Photochemistry of benzene in aerated aqueous solutions in the range of 214 to 265 nm [J].The Journal of Physical Chemistry,197 6,80(6):584-87.
[11]M P Irion,?et al?.UV-laser induced photo-oxidation of aqueous b enzene solutions:formation of phenol [J].Applied Physics B,1982,27:191-194.
[12]J 哈利斯,等.有机反应机理的基本原理[M].上海:上海科学技术出版社 ,1984.
作者简介: 李俊杰(1964-),男,河南许昌人,华东理工大学环境工程系在读博士研究生,研究方向为净水技术。
电话:(021)64253089?
E-mail:yuwand@163.com
收稿日期:2001-07-02
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








