稳定性二氧化氯溶液中二氧化氯存在形态的研究
贺启环 谢惠芳
(南京理工大学环境科学与工程系,南京210094)
摘 要 本文首先通过理论分析,以为二氧化氯(ClO2)在稳定性二氧化氯溶液(简称稳定液)中存在的形态根据所用稳定剂的不同而有区别。通过对几种样品的红外光谱分析、纸色谱分析、酪氨酸显色反应及抗酸缓冲能力的测定,证实在以过碳酸钠为稳定剂的稳定液中,ClO2以亚氯酸根离子(ClO2-)形式存在,并处在一个由NaHCO3-Na2CO3组成的缓冲体系中;在以过H3BO3-NaB4O7硼酸钠为稳定剂的稳定液中,ClO2可能是以活性配位化合物的形式存在,并处在由组成的缓冲体系中。这一结论对稳定性二氧化氯溶液的生产、贮存和应用是有重要的指导作用。
关键词 二氧化氯 稳定性二氧化氯 二氧化氯形态
Study on present form of chlorine dioxide in stabilized chlorine dioxide solution
He Qihuan Xie Huifang
(Dept. Of Environmental Science & Engineering of Nanjing University of
Science & Technology, Nanjing 210094)
Abstract Firstly depending on theoretical analysis, this paper suggests that chlorine dioxide (ClO2) in stabilized chlorine dioxide aqueous solution (stabilized solution) has different present form because of the different stabilizer used. On the basis of the analytical results of infrared spectrometry,paper chromatography,tyrosine color development reaction and the assay of anti-acid buffer capability, it was confirmed that the chlorine dioxide in stabilized solution with sodium percarbonate as stabilizer is present in the form of a chlorition (ClO2-) and together with NaHCO3—Na2CO3 buffer system. When the stabilizer is sodium perborate, chlorine dioxide may be retained in the solution comprised of H3BO3—Na2B4O7 as a labile complex. These results related above will have important guide effect on product,store and application of stabilized chlorine dioxide solution.
Keywords chlorine dioxide stabilized chlorine dioxide Chlorine dioxide form
1.前 言
由于二氧化氯(ClO2)的不稳定性,一般情况下商业上不便制成压缩气体或浓缩溶液(稳定液)是一种将高纯度的二氧化氯稳定在稳定剂中所形成的无色惰性混合液。我国已于1966年制定了该产品的行业标准(HG/T2770—1996)。稳定液经加酸活化后可释放出ClO2来。从现象上看,酸性活化剂的作用是破坏了稳定液的稳定体西从而释放出原来稳定与其中的二氧化氯来,但二氧化氯分子在稳定液中以何种形态——分子、离子、配位化合物——存在,一直是人们感兴趣的问题。因为这一基础性问题的研究将对稳定性的生产与应用有重要的指导意义。
本课题的一部分内容发表于1997年的《工业水处理》上[1],该文明确指出:ClO2在以过碳酸钠为主稳定剂的稳定液中是以ClO2-形式存在。本文既是这一结论的背景材料,事隔四年后才发表,相信仍有现实意义。
2.稳定液中二氧化氯存在形态的理论分析
以有的研究表明,二氧化氯(ClO2)在水中溶解成黄绿色的溶液,与氯气不同,它在水中不水解,也不聚合,在PH=2~9范围内以一种溶解的气体存在,具有一定的挥发性;而稳定性二氧化氯溶液是一种无色、基本无味的惰性溶液(相对于ClO2而言),显然二氧化氯分子在进入稳定剂中后发生了物理、化学作用,分子形态发生了变化,不可能在以原来的ClO2分子形式存在。
一个值得注意的现象是无色的亚氯酸钠(NaClO2)溶液,用酸性物质酸化后也能反应释放出ClO2来,反应式如下:
5NaClO2 + 4HCl → 4ClO2 + 5NaCl + 2H2O (2-1)
5个ClO2-生成4个ClO2,其中一个ClO2-作为氧化剂被还原成Cl-。反过来看,用ClO2生产亚氯酸钠时,在碱性条件(用NaOH)下,用过氧化氢(H2O2)作还原剂,使ClO2还原成ClO2-:
2Cl2+2NaOH+H2O2 → 2NaClO2+2H2O+O2 (2-2)
计算该反应的标准自由焓G=-ZEF=-167.15KJ/mol<0,表明该反应在常温下可自发进行。这一反应实际上与用碱性过氧化物作稳定剂生产稳定性二氧化氯溶液有相似之处:
2ClO2+2Na2CO3+H2O2 → 2NaClO2+2NaHCO3+O2 (2-3)
这一反应与式(2-2)的区别在于此时的碱性条件是由Na2CO3提供的:
Kh1
CO32-+H2O → HCO3-+OH- (2-4)
Kh2
HCO3-+H2O → H2CO3+OH- (2-5)
其中水解常数Kh1=1.8×104,Kh2=2.3×10-8,可见Kh1>>Kh2,故以第一步水解为主。因此有理由认为,ClO2-是稳定液中ClO2最可能存在的形态。根据Harrison纸层析实验,1990年就有人提出了这种观点[2],在实验中得到的稳定性二氧化氯的色谱斑与纯二氧化氯溶液的色谱斑不同,二与亚氯酸钠溶液的色谱斑相似。
美国专利[3][4]认为稳定性二氧化氯溶液中二氧化氯以某种活性配位化合物(labile complex)的形式存在,并得以稳定。这些专利均采用过硼酸钠为稳定剂,但未给出其存在的分子式。提出这种观点是基于以下原因:所形成的稳定性二氧化氯溶液未经二氧化氯在水中的快速分解过程,而二氧化氯又以一种极易释放的形式存在,在酸化条件下很容易产生气态二氧化氯。化合物的性能测试表明溶液中存在大量的配位化合物。另一方面,以配位化学的观点看,二氧化氯中氯原子采用SP2杂化,在其一个杂化轨道上存在着一个孤对电子;而硼原子是缺电子原子,具有接受孤电子对的条件,故它们形成配位物的可能性是存在的。值得注意的是ClO2-的轨道杂化为不等性SP3,具有二个孤电子对,也具有与硼原子形成配位物的能力。
另一份美国专利[5]则认为用过碳酸钠代替过硼酸钠作稳定剂,通过过氧根以某种化学键的方式把二氧化氯偶合到过碳酸钠上,由此把二氧化钠稳定在水溶液中。该专利并声称:在任何情况下,二氧化氯都不会以亚氯酸盐或亚氯酸的形式存在。显然这一观点忽略了过碳酸钠在水溶液中稳定性较差这一个事实。
3.样品的准备
样品A: 市购沪产稳定性二氧化氯溶液,PH=9.52,ClO2含量=20493mg/L;
样品B:市购中美合资生产的稳定性二氧化氯溶液,PH=8.73,ClO2含量=20246mg/L;
样品C:酸化NaClO2发生ClO2气体,用过碳酸钠(2Na2CO3ּ3H2O2)作为稳定剂吸收ClO2制备的稳定性二氧化氯溶液,PH=9.91,ClO2含量=26262mg/L;
样品D:酸化NaClO2发生ClO2气体,用过硼酸钠(NaBO3ּ4H2O)作为稳定剂吸收ClO2制备的稳定性二氧化氯溶液;PH=9.35,ClO2含量=23527mg/L;
样品E:由我们开发的新工艺,用过碳酸钠作稳定剂制备的稳定性二氧化氯溶液,PH=9.48,ClO2含量=33118 mg/L;
样品F:用工业NaClO2配制而成的7%(w/w)亚氯酸钠溶液;PH=11.5,ClO2含量=33377mgL;
样品G:酸化NaClO2发生二氧化氯气体,并通过NaClO2溶液进一步纯化,再用蒸馏水吸收纯化后的ClO2制备的纯二氧化氯水溶液,装瓶封口与冰箱冷藏,PH=6.5,ClO2浓度=400~600mg/L。
以上共六个样品,ClO2含量用碘量法测得。
4.样品的检测与结果分析
4.1 红外吸收光谱分析
用7400 型红外分光光度计测得的6个样品的红外谱图如图4-1至图4-6所示,图4-7和图4-8为所用稳定剂的红外谱图,而图4-9至图4-11为原料的标准红外谱图。
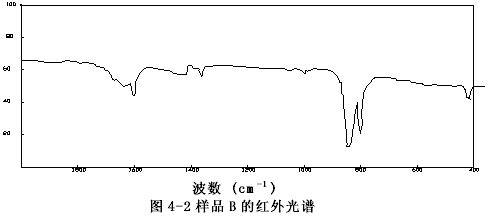
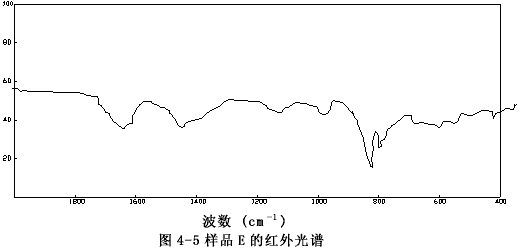
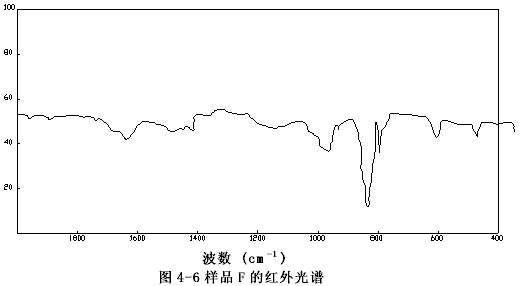
由图4-1至图4-6可以看出样品A、B、C、E、F的图谱很相似,其主要峰(800~840cm-1)重合,特别是样品A与C,它们的图谱几乎完全一致,这表明市购的产品与自制的稳定性二氧化氯溶液的主要成份是一样的。
图4-1 样品A的红外谱图
图4-2 样品的B红外谱图
图4-3 样品的C红外谱图
图4-4 样品的D红外谱图
图4-5 样品的E红外谱图
图4-6 样品的F红外谱图
图4-7 过碳酸钠(原料)红外谱图
图4-8 过硼酸钠(原料)红外谱图
图4-9 亚氯酸钠标准红外谱图
图4-10 NaBO3ּ4H2O标准红外谱图
图4-11 NaBO3ּH2O标准红外谱图
样品C的谱图(图4-3)与过碳酸钠的谱图(图4-7)相比存在极大的差异,而和样品F亚氯酸钠溶液的谱图(图4-6)十分相似,它们的主要吸收峰均在800和840cm-1处,以亚氯酸钠的标准谱图(图4-9)上可以看出,这正是亚氯酸根吸收峰的位置。有所不同的是样品F的谱图中,在930~1000 cm-1处的吸收峰(ClO3-的特征峰之一)在样品C的谱图中变得很弱了,这说明样品F中所含的氯酸根(ClO3-)在样品C中以大大减少了。
样品D的谱图(图4-4)则与样品A、B、C、E、F的明显不同,它的吸收峰要复杂得多,和过硼酸钠的谱图(图4-8)相比主要吸收峰也发生了变化,这说明样品D中有完全不同的一类新物质生成,文献[3][4]认为这是一种(系列)活性配位化合物。由于硼系化合物的组成本来就很复杂,又易形成各种配位化合物及各种形式的水合物,所以吸收峰多也是符合理论的。
4.2 纸色谱法
纸色谱法是一种利用滤纸进行物质分离分析的方法,又称为纸上层析。系用滤纸(纤维素)为固定载体,选用“异丙醇-水-吡啶-浓氨水”体系作为展开溶剂,这种溶剂可以用来分离出氯化物、亚氯酸盐、氯酸盐和高氯酸盐,显色剂则采用二苯胺。
图4-12 纸色谱照片
图4-13 纸色谱图色斑描绘图
由图和图可以看出,样品G 不显色斑,样品C、D、E、F在初期只显示一个斑点,放置过夜后其中样品C、E、D的斑点发生了变化,出现了拉长的色斑,这三个样品均含有过氧化物,溶液中过氧化物的存在导致一段时间后显色剂氧化显色。
样品C 和E的色谱斑其位置、形状与样品F的相似,这表明它们的主要组成中均含有亚氯酸根和一定量的过氧化物。
样品D的色谱斑与其它样品的则存在着明显的差异,斑点拉长也表明含有一定量的过氧化物,由于硼的过氧化物较过碳酸钠稳定,在溶液中保存期也更长一些,所以色斑拉长更为明显。
4.3 酪氨酸显色反应
二氧化氯能与酪氨酸发生显色反应生成多巴醌类显色化合物,当溶液中含有次氯酸根(ClO-)和亚氯酸根离子(ClO2-)时,能灵敏地测出ClO2的含量[6]。6个样品测定结果显示只有纯水溶液(样品G)和酪氨酸试剂发生显色反应,其它样品则只有酸化产生游离ClO2后才发生显色反应,这表明这些样品中不存在以分子态形式存在的ClO2分子,它们只能以离子或化合物的形式存在。
4.4 抗酸缓冲能力测定
用6mol/L的盐酸(HCl)溶液滴加到50ml样品中,测定pH值的变化,得到样品的PV-V(HCl)图,如图4-14所示。
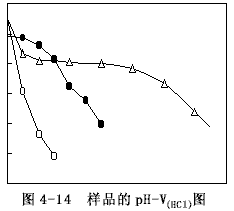
样品C在加酸过程中有气泡产生,这是缓冲体系受到破坏产生CO2之故,而样品D及F无气泡产生。由图4-14可以看出,样品F随盐酸溶液加入量的增加,pH呈直线下降,对酸没有缓冲能力。样品C则在pH=6~8之间有一明显的平台,表现了很强的缓冲能力,表明用过碳酸钠作稳定剂的稳定液中具有多元酸的酸式盐(NaHCO3)与次级盐(NaHCO3)组成的缓冲体系,这与前述的理论分析是一致的。样品D的缓冲能力介于样品F与C之间,这表明过硼酸钠作稳定剂的稳定液中也存在由弱酸(H3BO3)及其对应的盐(Na2B4O7)组成的缓冲体系。
5.结 论
通过以上的实验与测定及其它文献[2][3][4]的报道,可以证明我们最初的理论分析是正确的,并由此得到以下几个结论:
(1)在以过碳酸钠(或碳酸钠-过氧化氢)为稳定剂的稳定性二氧化氯溶液中,二氧化氯以亚氯酸根的形式存在,并处在一个由NaHCO3-Na2CO3组成的缓冲体系中,其加酸活化过程实质上是一个酸化反应过程;进一步的测试结果也表明[7],其酸化时反应的计量关系符合式(2-1)。
(2)在以过硼酸钠为稳定剂的稳定性二氧化氯溶液中,二氧化氯可能以某种极性较弱(弱配位键)的活性配位化合物形式存在,并处在一个由H3BO3-Na2B4O7组成的缓冲体系中。加酸酸化时配位体同氢离子结合成弱酸,破坏了配合平衡导致活性配位物解体,从而释放出ClO2来,因此可以认为这才是一个真正的“活化”过程。
参考文献
1) 谢惠芳,贺启环。非水溶液法制备稳定性二氧化氯新工艺[J]。工业水处理,1997,14(3):14,42。
2) 梁增辉,扬宗芬,王福玉等。值对稳定型二氧化氯消毒剂活化影响的研究[J]。中国消毒学杂志,1990,7(1):1~5。
3) Moises L. de Guevara, etal. AQUEOUS CHLORINE DIOXIDE ANTISEPTIC COMPOSITIONS AND PRODUCTION THEREOF [P]. U. S. P:2,701,781,1955.
4) Thomas P. Mcnicholas, etal. STABLE CHLORINE CIOXIDE COMPOSITION AND METHOD OF MADING SAME [P]. U. S. P: 3,271,242,1966.
5) Thomas P. Mcnicholas, etal. PROCESS FOR STABILIZING CHLORINE PLOXIDE SOLUTION. U. S.P: 3,278,447,1966
6) 扬宗芬,梁增辉,王富玉等。比色法测定二氧化氯含量[J]。消毒与灭菌,1989,6(4):196~198。
7) 徐瑞群,贺启环。硕士学位论文:二氧化氯分析方法研究与二氧化氯消毒制剂测试[D]。南京:南京理工大学,2000。
[中图分类号] TQ124、4+3
附 图:






作者简介:贺启环,1943~,南京理工大学环境科学与工程系主任、副教授,发表论文40余篇。电话:025-4435333。
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








