臭氧湿式氧化氨氮的降解过程研究
钟理1,Kuo C. H.2?
(1.华南理工大学 化学工程学院, 广东 广州 510641;2.Depart. of Chem. Eng.,Missis sippi State Univ.,MS 39762,USA)
摘要: 采用O3湿式氧化降解含氨氮的废水,研究了不同pH、温度、初始氨浓度对反应过程的影响,探讨了在高pH时O3的自分解催化产生自由基·OH机理 和污染物的氧化降解过程。通过试验,获得了O3氧化氨氮过程的动力学方程。?
关键词: 臭氧; 氧化;降解;氨氮
中图分类号: X703
文献标识码: A
文章编号:1000-4602(2000)01-0014-04
Investigation on Wet-Ozonization Degradation of Ammonia Nitrogen
ZHONG Li 1, Kuo C. H.2?
(1.School of Chem. Eng., South China Univ. of Technology, Guangzhou 51064 1, C hina; ?2.Depart. of Chem. Eng., Mississippi State Univ., MS 39762, USA)
Abstract:The effect of pH value, temperature and initial ammonia concentrat ion on reaction process was studied by using wet?ozonization process for degrading NH3-N wastewater. The mechanisms for catalytic generation of hydroxyl radic al s by ozone decomposition at high pH values, and the oxidative destruction of polutants were explored. The kinetis equation of ozonizing NH3-N process was obtained based on the experiment. ?
Keywords: ozone; oxidation; degradation; ammonia nitrogen
目前含氨氮废水的处理技术有[1、2]:合成硝化法、离子交换法、空气蒸气气提法、液膜法、氯化或吸附法以及湿式催化氧化法等。其中O3在碱性条件下的湿式催化氧化过程是一种处理含氨氮废水比较有效的技术,它可以作为既含有机物又含无机污染物废水的预处理,也可以作为废水的深度后处理以进一步降解废水中的污染物。
1 试验部分
1.1 试验装置
主要装置是Hi-Tech Model SF-51型Stopped Flow光谱仪反应器(图1),英国制。该仪器可以在线连续准确测定反应组分对光的吸收率与时间的关系,时间的选择范围在0.001~7500s,即可准确测定千分之一秒内的反应速率,尤其适用于快速反应过程测量。L-50型臭氧发生器产生臭氧,臭氧浓度由碘滴定法测定,含氨氮废水用NH4Cl自配,溶液的氨氮浓度用氨电极测定。?
首先作出O3和氨对紫外光(UV)的吸收曲线,结果表明在260nm波长时,O3的吸收率比氨高约6~9倍。在氨氮的氧化过程中,O3作为有限反应物,氨相对过量,因此可通过测定有限反应物对光的吸收率随时间的变化关系得到氨氮降解过程的动力学常数。
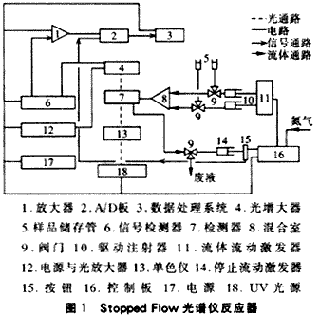
1.2 试验原理
氨氮的O3湿式氧化总反应可由以下方程表示:
aO3+NH![]() QS(含NO3-或NO2-的产物) (1)
QS(含NO3-或NO2-的产物) (1)
基于上述反应的臭氧或氨衰减动力学方程为:
γ=[-dCo3/dt]/a=-dCNH3/dt=kCo3mCNH3n (2)
设氧化反应遵守Arrhenius定律,则速率常数与温度的关系为:
k=k0exp[-E/(RT)] ?(3)
试验中保持氨大量过量,或者反应过程中CO3浓度较小时,式(2)可以近似为:
γ=[-dCo3/dt]/a=-dCNH3/dt=k′Co3m (4)
k′=kCNH3n (5)
氧化降解过程动力学常数的确定通常有微分法和积分法等,本文采用积分法。在恒定的温度、氨浓度时,根据式(4)对试验数据回归分析,可确定相对于O3浓度的反应级数m、表观速率常数k′。改变氨浓度,由式(5)可确定相对于氨浓度的反应级数n、速率常数k。改变温度,重复上述步骤,由式(3)可获得活化能E和指前因子k0。?
2 结果与讨论
2.1 计量比的确定
在决定氨氮氧化反应计量比a时,将已知浓度O3水溶液与适量的氨氮(实际上是含NH4Cl与NH3)溶液混合,使其中一种反应物完全消耗掉,溶液中初、终O3浓度用碘滴定法测定,氨的浓度根据下面的平衡关系,用氨电极测定。?
 (6)
(6)
在不同pH时反应过程消耗的氨摩尔分数XNH3对初始C0,O3/C0,NH3摩尔比关系绘于图2。由图2可见,计量比a在5~6之间。

2.2 氨氮的O3湿式氧化反应
试验是在温度为283~313K和pH=7~10条件下进行,初始O3浓度为0.0002mol/ L,氨的初始浓度为0.0006~0.002mol/L。图3给出温度为298K和不同pH时无量纲O3浓度与时间在半对数坐标上关系为一直线,表明氧化过程相对于臭氧浓度为一级(m=1)

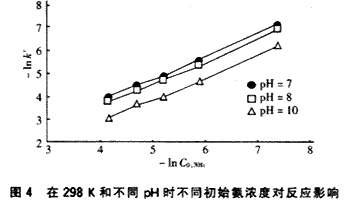
在对数坐标上作出表观速率常数k′与初始C0,NH3关系如图4,直线斜率为1,表明反应相对于氨浓度为一级(n=1),回归分析可得温度为298K、pH=7、8、9、10时氨的臭氧化反应速率常数k分别为5.8 12.3、16.7和27.8。?
在pH=9及不同温度下的k对1/T?在半对数坐标上作图是一直线,由直线的斜率和截距可得活化能E为3.74×104,指前因子k0为5.91×107,试验结果列于表1。
2.3 臭氧湿式氧化氨氮的降解过程探讨
由上述结果可见,氨氮的氧化反应计量比在5~6之间,即每破坏1 mol氨所需的O3约为5~6mol,且随着pH增加而减少。虽然pH增加,O3的自分解速率加快,但O3自分解与O3氧化NH3的竞争结果是O3对氨的氧化比O3的自分解速率快,从而使计量比下降。这表明在高pH时增加的O3与NH3的反应足以补偿自分解消耗的O3,能更有效地利用O3。?
由图3、4及表1的结果显示,O3对NH3的氧化降解随着溶液的pH增大而加快,这是因为pH高会加快O3的分解,诱发产生一种氧化能力更强的·OH自由基,NH3的降解既存在直接的O3分子氧化,还存在·OH自由基氧化反应。在pH低时,以直接臭氧氧化控制为主,在pH高时,以自由基氧化控制机制为主,且·OH自由基氧化速率更快[3],可能的反应机理为[4]:
O3+OH→HO2-+O2
O3+HO2-→·OH+O2-+O2 (8)
O3+NH3![]() Qs(pH值低时,O3直接氧化为主) (9)?
Qs(pH值低时,O3直接氧化为主) (9)?
·OH+NH3![]() Qs(pH值高时,·OH自由基氧化为主) (10)?
Qs(pH值高时,·OH自由基氧化为主) (10)?
此外,废水是用NH4Cl药剂配制,溶液中既存在NH3分子(游离氨),也存在着NH4+(氨离子),O3和·OH自由基可氧化游离NH3分子,不能氧化NH4+,根据平衡关系式(6),pH增加,平衡向右移动,溶液中的游离NH3分子增加,有利于反应进行。因此,氨氮的O3湿式氧化降解应在碱性(pH=9~10)条件下进行。?
本试验用NH4Cl作为试验药剂,从热力学的角度,Cl-可被O3或·OH氧化为Cl2,Cl2可以氧化NH3,为了证明NH3究竟主要被O3、·OH自由基氧化还是被Cl2氧化,试验还用了(NH4)2SO4代替NH4Cl进行对比,所得的结果与用药剂NH4Cl的相似,说明Cl2对NH3--O3的系统没有影响,NH3主要被O3或·OH所氧化。试验还测定了最终的产物组成,用磺胺酸-萘胺盐酸盐分析结果表明,废水中的氨氮最终氧化产物主要是NO3-而不是NO2-。
3 结论
废水中的氨氮可以有效地被O3氧化降解(在本试验范围,反应计量比为5~6),且与溶液的pH有关,pH提高可降低计量比,提高O3的利用率。此外,pH增大可加快氨的被氧化速率。在pH低时,氧化机理主要是O3分子直接氧化机制;当pH增加,诱发产生一种氧化能力很强的·OH自由基,氧化机理主要是自由基氧化机制,氧化速率显著加快,故氨氮的臭氧湿式氧化降解应在碱性条件(pH=9~10)下进行。通过对试验结果回归分析,得到pH=9时氨氮经臭氧湿式氧化降解的动力学方程:
γ=[-dCo3/dt]/a=-dCNH3/dt=kCo3mCNH3n
a=5.5
k=5.91×107exp[-3.74×104/(RT)]
参考文献:
[1] Harrison C C etal. The UV-enhanced decomposition of aqueous a mmonium nitrite[J]. J Photochem Photobiol,1995,89(3):215.
[2] Magara Y,Itoh M. The effect of operational factors on solid/liqui dseparation by ultra-membrane filtration in a biological denitrification system for colledcted human excreta treatment plants[J], Water Sci Tech, 1991,23:158 3.
[3] 钟理,Kuo C H.叔丁醇的复合氧化反应动力学及其降解的研究[J].高校化 学工程学报,1999,13 (3):229.
[4] 钟理,Kuo C H.臭氧与过氧化氢的反应动力学及机理[J].华南理工大学学 报,1997,25(12):50.
基金项目: 广东省自然科学基金资助课题 (990642)
作者简介: 钟理(1956- ),男,湖北人,华南理工大学化工学院教授,博士,研究方向:环境工程,化学工程。
电话: (020)87111517?
E-mail celzhong@scut.edu.cn
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








