二氮杂菲分光光度法测饮用水Fe2+时,缓冲溶液PH的计算
二氮杂菲分光光度法测饮用水Fe2+时,缓冲溶液PH的计算
秦梅
秦皇岛市自来水总公司山海关公司 河北 邮编:066200
摘要:《二氮杂菲分光光度法测铁中,缓冲溶液PH的计算》是根据我在工作中实际遇到的问题而写的,从发现问题、分析问题、和解决问题的三部分对测铁中缓冲溶液的PH的计算加以阐述,解决现在药剂质量不稳定的情况下,如何使实验中加入乙酸乙酸铵缓冲溶液后的PH保持在它的缓冲范围3.76-5.76,使实验顺利进行这一问题,对于缺乏大型精密仪器实验条件的基层,我觉得这个问题的解决很有必要。
关键词:缓冲溶液、PH值、共轭酸碱、
1、概述:
铁是水中最常见的一种杂质,含铁量少的水对人体健康并无影响,但含铁量太高的水易产生一些特殊气味,饮用时很不可口。饮用水中的铁的容许量为≤0.3mg/l,水中含铁量在1mg/l左右,就易与空气中的氧作用而产生浑浊现象。
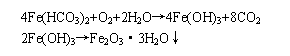
因此我们依据2001年9月1日起实施的《生活饮用水卫生规范》(以下简称《规范》)中的二氮杂菲分光光度法测定水中的铁。
2、二氮杂菲分光光度法测铁的原理
Fe2+与二氮杂菲在PH3-9的溶液中生成水溶性的橙红色螯合物[(C12H8N2)3Fe]2+,该螯合物在水溶液中非常稳定,它的logKf=21.3,摩尔吸光系数ε510=1.1 × 104,其反应式如下:
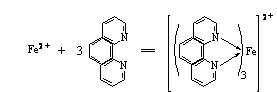
生成的红色螯合物的最大吸收峰在510nm处。本方法选择性很高,相当于含铁量40倍的Sn2+、Al3+、Ca2+、Mg2+、Zn2+、SiO32-,20倍的Cr3+、Mn2+、V(Ⅴ) 、PO43-,5倍的Cu2+、Co2+等均不干扰测定。Fe3+也能与二氮杂菲反应生成淡蓝色配合物,因此,在显色前,首先用盐酸羟胺把Fe3+离子还原为Fe2+离子,其反应式如下:
4Fe3+ + 2NH2OH·HCl → 2Fe2+ + N2↑ + 2H2O + 4H+ + 2Cl-
测定时,溶液pH值控制在5左右,酸度高时,反应进行较慢,酸度太低,则Fe2+离子水解,影响显色。由此,我们不难看出做此项实验时,溶液最后的pH值的大小对实验的成败起着至关重要的作用。
3、实验中出现的问题
在二氮杂菲分光光度法测铁的实验操作中,常会出现当最后加完PH值=4.2的乙酸乙酸铵缓冲溶液(按照《规范》所规定方法配制)时,溶液中不出现橙红色物质而是无色透明的,通过分析我们排除了其它因素,确定是乙酸乙酸铵缓冲溶液出现问题。我们用精密pH计测定其PH=3.38。我们用《规范》中的方法又重新配制一次发现还是PH=3.38,我们认为目前方法配制的乙酸乙酸铵缓冲溶液PH,在我们的实验中已不能满足要求,我们认为在药剂质量不稳定的今天,这个问题有其普遍性,因此,我们应认真对待。
4、实验中不同pH值缓冲溶液的确定
4.1公式的推导
在乙酸(HAc)乙酸铵(NH4Ac)缓冲溶液中:
平衡时,存在着较多的HAc 分子和Ac-,当外加酸时,外加的H+与Ac-结合成难电离的HAc分子,同时阻止HAc进一步电离,故不会使溶液中的[H+]急剧增大,从而使PH保持不变。如果外加少量碱,则由强碱电离出来的OH-就会与HAc电离出来的H+结合成H2O,这时[H+]下降,平衡向着电离方向移动来补充H+,从而保持PH基本不变。 在HAc——Ac-缓冲体系中,依据(1)、(2)式 它的电离平衡常数 Ka =[H+][Ac-]/[ HAc] [H+]= Ka[ HAc]/ [Ac-] 等式两边取负对数-lg[H+]=-lgKa+{-lg[ HAc]/ [Ac-]} 即PH=PKa+lg{ [Ac-]/[ HAc]} 其中 PKa=4.76 ……(3) 从(3)式可以看出:该缓冲溶液的PH主要决定于PKa,同时与其共轭酸碱的浓度比[Ac-]/[ HAc]有关,对于同种缓冲液PKa一定,PH随[Ac-]/[ HAc]而变化,当温度一定时,溶液PH不因稀释而产生明显的变化,具有一定的抗稀释作用。缓冲溶液的缓冲能力是有限的,而不是无限,的。当其抗酸抗碱成分用尽时,就无缓冲能力了,足够浓度的共轭酸共轭碱组成的缓冲溶液,其PH变化范围大致相当于PKa±1,约2个单位范围,才能发挥满意的缓冲作用。由此看出,乙酸(HAc)乙酸铵(NH4Ac)缓冲体系的PH有效缓冲范围是:3.76-5.76,加入缓冲溶液后的待测样的PH只要达到这个范围,哪怕只是刚刚进入这个范围如:达到3.78,都会出现变色,并且增加缓冲溶液的体积对显色速度不起作用。依据以上理论,我们通过计算结合试验来配制适合pH值的HAc——Ac-缓冲溶液,以抵消药剂质量的影响,使pH值能够满足3.76-5.76这一范围。 ∵在HAc——Ac-缓冲体系中PH= 4.76+lg{[Ac-]/[ HAc]} ∴ 4.2= 4.76+lg{[Ac-]/[ HAc]} Lg{[Ac-]/[ HAc]}=-0.56 [Ac-]/[ HAc]=0.27 ∵在此缓冲体系中Ac-主要来自NH4Ac的电离, ∴[Ac-]=[ NH4Ac] ∴[Ac-]/[ HAc]= [ NH4Ac] /[ HAc]= 0.27 又∵HAc、NH4Ac处于同一体系, ∴[ NH4Ac] /[ HAc]= NH4Ac的摩尔数/ HAc的摩尔数 ∵NH4Ac的分子量是77 ,实验用冰乙酸HAc的摩尔浓度是17mol/l ∴如果取乙酸铵250克溶于少量纯水,需要加多少毫升冰乙酸混匀才能成为PH=4.2缓冲溶液呢? [Ac-]/[ HAc]= [ NH4Ac] /[ HAc]=(250/77)/(17×V)=0.27 V=0.7L=700mL 即取乙酸铵250克溶于少量纯水,需要加700毫升冰乙酸混匀才能成为PH=4.2的缓冲溶液。 同理,我们可以根据此种方法计算出其它适合自己需要的PH缓冲溶液。当然,配制不同PH的乙酸乙酸铵缓冲溶液时,它的PH必须在3.76-5.76这个范围,大于或者小于这个范围,其缓冲比[Ac-]/[ HAc]〉10或〈0.1,缓冲容量小于0.01,不具有缓冲能力。 5、结束: 在基层化验室没有较精确的大型检测设备,可见光分光光度计就属于很精密的仪器了,在这种条件下,我们只有凭着精益求精的态度做好化验工作,虽然基层的化验员会更辛苦,但我们会以更加认真、更加务实的态度做好最基层的化验工作。以上是我把二氮杂菲分光光度法测铁中,缓冲溶液PH计算方法呈现给大家,如有纰漏欢迎各位同行的指正。 姓名秦梅年龄33岁,1996年毕业于河北建筑工程学院给排水专业本科学士学位,现工作于秦皇岛市自来水总公司山海关公司水质科,职务是水质科长,职称是给排水工程师。 通讯地址:秦皇岛市山海关自来水公司水质科 秦梅
4.2乙酸(HAc)乙酸铵(NH4Ac)缓冲溶液pH计算
我们以《规范》中所配制的pH=4.2的乙酸(HAc)乙酸铵(NH4Ac)缓冲溶液为例计算。
为方便大家,下表为采用以上方法计算出其它PH的缓冲溶液的乙酸铵和乙酸的理论用量,在实验中要进一步测量配制溶液的PH:
邮编:066200
电话:0335-5027069(单位)
电子信箱:liwei3162316@163.com
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








